1. Das funções químicas inorgânicas
Em química, possuímos 5 tipos de funções, dentro das quais estaremos abordando apenas 4 para a preservação mental dos nossos caros leitores. As funções são definidas por um conjunto de compostos químicos que possuem características em comum entre si, sendo estes agrupados em:
- Ácidos: Pela definição de Arrhenius, é todo composto que em meio aquoso libera cátions de Hidrogênio, os H+. Nos aprofundaremos mais nessa família de compostos mais à frente.
- Bases: Segundo também Arrhenius, é todo o composto que molhado, ou seja, em solução aquosa, libera ânions de Hidroxila, os OH-.
- Sais: São os compostos iônicos resultantes da reação química entre uma base e um ácido, possuindo 1 cátion diferente de H+ e 1 ânion diferente de OH-.
- Óxidos: compostos binários que possuem o Oxigênio (O) como o elemento mais eletronegativo.
2. Da solução dos ácidos
Retornando à formulação de Arrhenius, todo aquele composto que libera H+ em solução aquosa é caracterizado como um ácido. Para exemplificar e equacionar esta reação, utilizaremos o Ácido Sulfúrico, de fórmula H2SO4 em meio aquoso, ou seja, em H2O. Seguem abaixo ilustrações de como se dá a reação:
Devido
à maior eletronegatividade dos átomos de Oxigênio (O) da molécula de água, os
dois átomos de Hidrogênio (H) do ácido sulfúrico acabam adquirindo cargas
parciais positivas, pois seus únicos elétrons passam a orbitar os átomos de
Oxigênio. Sua interação com a água se deve ao ataque dos pares de elétrons não
ligantes do átomo de Oxigênio presente no H2O aos átomos de
Hidrogênio do ácido sulfúrico. A partir disso, os dois Hidrogênios cedem seus
elétrons aos Oxigênios do ácido sulfúrico e passam a fazer parte da molécula de
água. Este processo é definido pela seguinte equação:
H2SO4
+ 2H2O → 2H3O+ + SO42-
Os
ácidos podem ainda diferir quanto a sua composição, dividindo-se em dois
grupos:
-
Hidrácidos: ácidos que não possuem átomos de Oxigênio (O) em sua composição,
sendo formados geralmente por um átomo de Hidrogênio (H) e outro elemento. Ex.:
HCl, HBr, H2S.
-
Oxiácidos: são aqueles que possuem átomos de Oxigênio (O) em sua composição,
sendo formados por Hidrogênio (H), Oxigênio (O) e outro elemento que o difere
dos demais ácidos. Ex.: H2SO4, HClO, HNO3.
3. Dos Números de Oxidação dos elementos
Por
definição, o NOx, ou Número de Oxidação de um elemento, é a carga eletrônica
dele num composto químico dada a sua eletronegatividade. Isso significa que a
eletronegatividade ditará se um composto assume carga positiva, que é quando
possui menos elétrons orbitando em sua eletrosfera do que prótons em seu
núcleo, ou negativa, o inverso da organização já citada. Elementos mais
eletronegativos tendem a se tornar mais negativamente carregados em ligações
químicas, roubando, isto é, atraindo com mais intensidade os compartilhados dos
elementos menos eletronegativos ao redor.
Em
ligações iônicas, o NOx é igual à carga do elemento, pois ocorre a
transferência quase completa de elétrons do elemento menos eletronegativo para
o mais eletronegativo. Um exemplo seria do composto iônico NaCl (Cloreto de
Sódio, mais conhecido como sal de cozinha). O Sódio (Na) perde 1
elétron para o Cloro (Cl), adquirindo carga igual a +1, enquanto que o cloro
recebe um elétron, adquirindo carga igual a -1. Vale lembrar que a soma das
cargas num composto químico sempre deve ser igual a zero.
Em
compostos covalentes, onde há o compartilhamento de elétrons, deve-se seguir a
eletronegatividade dos elementos. Aquele mais eletronegativo receberá os
elétrons e aquele menos eletronegativo doará, simulando uma ligação iônica.
Tomemos
como exemplo a molécula da água (H2O):
A
carga parcial de um elemento é representada pela letra grega delta (δ) e pode
assumir sinal positivo (quando a partícula está positivamente carregada) ou
sinal negativo (quando está negativamente carregada).
O
número -2 do Oxigênio (O) mostra que este recebeu dois elétrons a mais de cada
Hidrogênio (H) menos eletronegativo. O número -2 é o Número de Oxidação do
Oxigênio, ou seja, a quantidade de cargas que este possui no composto. Cada
Hidrogênio (H) recebe então o NOx +1 (representado apenas pelo sinal +) por ter
cedido 1 elétron cada para o elemento mais eletronegativo. A carga da molécula
precisa ser igual a zero, a menos que esta seja um íon.
A
soma das cargas +1 de cada Hidrogênio (H) com a carga -2 do Oxigênio (O) zera a
carga molecular.
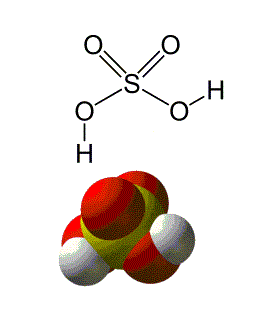
Usando
outra molécula, dessa vez mais complexa, para descrever o NOx de cada elemento
participante, temos:
O Enxofre possui NOx igual a +6, pois cede elétrons à
todos os átomos de Oxigênio (O) com os quais se liga.
Os dois átomos de Oxigênio (O) que estabelecem uma
ligação dupla com o Enxofre (S) possuem NOx -2 cada um.
Cada Oxigênio (O) que realiza ligação simples com o
Enxofre (S) tem NOx igual a -2 cada, pois além de receber elétrons do Enxofre, recebe
também do Hidrogênio (H), que por sua vez detém NOx igual a +1 cada.
Ao somar as cargas de cada partícula, temos uma carga da
molécula igual a zero, estabilizando o composto.
Possuímos então o conceito de Número de Oxidação Máximo
e Número de Oxidação Mínimo. Esses dois números serão importantes para a
nomenclatura de certos tipos de ácidos. O NOx máximo é a carga de um elemento
quando este perde todos os elétrons de sua camada de valência que coincide com
o número da família que este ocupa na Tabela Periódica. O NOx mínimo é a
quantidade de elétrons que um elemento precisa receber para completar seu
octeto.
Um exemplo de NOx máximo é o do Enxofre (S) na molécula
de ácido sulfúrico (H2SO4) na qual tem a carga igual ao
seu NOx máximo, pois significa que este doou todos os elétrons de sua camada de
valência, tendo então o Número de Oxidação igual a +6.
Quanto ao NOx mínimo, temos como exemplo a molécula de
gás carbônico (CO2), em que cada Oxigênio (O) da molécula possui NOx
igual a -2, pois completa seu octeto ao receber dois elétrons.
4. Da nomenclatura dos Hidrácidos
Extremamente simples,
consiste na seguinte regra:
“Ácido” + Ed + sufixo
“ídrico”
Onde Ed significa
Elemento Diferencial, ou seja, o nome daquilo que não é Hidrogênio no ácido e
que diferencia os ácidos.
4.1 Da nomenclatura dos Oxiácidos
De
acordo com uma divisão feita pelos químicos para facilitar o estudo das funções
inorgânicas, ácidos no caso, os separaram em Hidrácidos e Oxiácidos.
Essa
divisão se deu pelo fato dos Oxiácidos possuírem métodos diferentes para
definir a sua nomenclatura, assim como sua força (propensão de liberar H+).
Para
definir os nomes deste tipo de ácido já é um processo um pouco mais extenso,
porém simples, observem a demonstração abaixo:
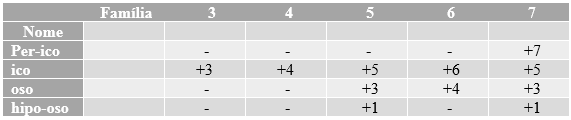
Primeiramente
lhes mostraremos a tabela pela qual vocês irão se orientar para encontrar o
nome do Oxiácido, de modo a definir o prefixo (se necessário) e o sufixo do
mesmo:
Tabela
1:
Dessa forma, a
formulação da nomenclatura seria:
“Ácido” + prefixo
+ Ed + sufixo.
Como exemplo,
citaremos novamente o H2SO4. Como a Família do Enxofre é
a 6A e o NOx dele nesta molécula também, usa-se o sufixo “-ico”. Logo, seguindo a regra da
nomenclatura, o nome do ácido seria Ácido Sulfúrico.
Mas, antes de
usarmos essa tabela, às vezes precisaremos fazer a formulação de um composto
antes.
Por exemplo: se te pedirem a fórmula do ácido que possui os átomos de Hidrogênio (H), Enxofre (S) e Oxigênio (O) em sua fórmula, como determinaria os índices de cada átomo?
Por exemplo: se te pedirem a fórmula do ácido que possui os átomos de Hidrogênio (H), Enxofre (S) e Oxigênio (O) em sua fórmula, como determinaria os índices de cada átomo?
Lembrando que índice
é a quantidade de cada átomo presente na molécula. Ex.: H2O, na
molécula de água, o índice do Hidrogênio (H) é 2, e do Oxigênio (O), 1.
Bom, há uma regra
para fazê-lo, o famoso “macete”. Já
iremos ressaltar que este modo de fazer a formulação não tem um porquê; um
cientista simplesmente percebeu o padrão, viu que funcionava em todos os casos
e criou a regra, sem necessidade de uma especulação científica. Dá certo porque
sim.
5. Da técnica da formulação de Oxiácidos
Bom,
primeiramente, sabemos que um Oxiácido será como um Hidrácido, porém com
oxigênio, então já compreendemos que o composto que devemos formular deverá
apresentar forma genérica:
Hn –
Ed – On
Na
qual H é o Hidrogênio, Ed é o elemento diferencial, O é o Oxigênio e n é o índice de cada átomo.
Agora começaremos
a demonstrar a técnica para determinar o número dos átomos de hidrogênio e
oxigênio.
H
= 8 – número da família do elemento diferencial
O
= 8/2 = 4
Exceção:
Quando o elemento diferencial for B (Boro), C (Carbono) ou N (Nitrogênio);
usa-se 6 no lugar de 8 para determinar o número de oxigênios e de hidrogênios.
Algo
importante de se ressaltar sobre esta regra, é que você sempre vai obter o
maior ácido possível para o elemento diferencial com qual você está
trabalhando.
Todos
os átomos de Oxigênio presentes em Oxiácidos terão NOx fixo -2. Pelo fato da
fórmula do ácido criada a partir da técnica acima demonstrada ser a maior
possível, há possibilidade da retirada de átomos de Oxigênio.
Caso
ocorra o decréscimo de átomos de Oxigênio consequentemente ocorrerá mudança no
NOx do elemento diferencial e, portanto, estaremos mudando sua posição na
tabela, mudando também a nomenclatura do ácido. Como o NOx do Oxigênio em Oxiácidos é fixo
-2, a cada decréscimo de átomos de Oxigênio ocorrerá também o decréscimo do NOx
no elemento diferencial em +2. Nesta última tabela, para cada oxigênio
perdido, usa-se o prefixo/sufixo que se segue:
Tabela
2:
Utilizaremos
como exemplo o H2SO4 novamente.
1º
passo: H = 8 – número da família do Ed
No
caso o enxofre da família 6A, então teremos:
8
– 6 = 2
Dois
átomos de Hidrogênio (H)
2º
passo: O = 8/2
O
= 4
Quatro
átomos de Oxigênio (O) na molécula.
A partir daqui só se falta determinar o nome. Já sabemos
que o ácido obtido aqui é o maior possível, com o maior número de átomos, então
já que a família do enxofre é menor do que 7, o sufixo usado será “-ico”. Tendo
em vista que o prefixo do “enxofre” é “súlfur”, nomea-se Ácido Sulfúrico.
Explicando
a citação anterior sobre os átomos de Oxigênio, consegue perceber o que
acontece a cada oxigênio perdido?
Cada
vez que se retira um oxigênio, o átomo de Enxofre (S) passa a “ganhar” dois
elétrons e seu NOx vai de +6 a +4.
Recordando
a Tabela 1, caso o NOx do elemento for +4, o ácido vai ser H2SO3 (por ter perdido um oxigênio) e,
quanto ao nome, devido o NOx ser +4, usar-se-á o sufixo “-oso”, e o nome será
Ácido Sulfuroso.
6. Da
relação dos NOx’s dos elementos com sua nomenclatura
Podemos
chegar à conclusão de que o NOx máximo e o mínimo possuem influência sobre a
nomenclatura do ácido.
Quando
se quer dar nome a um composto a partir de sua fórmula obtida na técnica
mostrada, usaremos sempre o sufixo “-ico” e se necessário o prefixo “per”, pois
já foi comentado anteriormente que quando usa-se essa regra, você estará
obtendo o maior ácido possível, logo, o NOx será máximo.
Quando
usa-se o NOx mínimo do elemento, temos então sempre o uso do sufixo “-oso” e se
necessário o prefixo “hipo”. Logo, observamos uma influência direta do NOx
máximo e mínimo com a nomenclatura de um Oxiácido.
A
conclusão que podemos alcançar é que, ao escrevermos a fórmula de um Oxiácido,
obtemos a maior quantidade de átomos de Oxigênio (O) e Hidrogênio (H) possível.
Para que sua nomenclatura seja alterada, basta retirar átomos de Oxigênio de
sua fórmula e observar a mudança de NOx do Elemento diferencial de acordo com a
Tabela 1 apresentada.
Referências
Referências - Imagens
RUSSEL, John B. Química
Geral, 2-ed, 2 vols.
Traduzido por: Márcia Guekezian; Maria
Cristina Ricci;
Maria Elizabeth Brotto; Maria Olívia A. Mengod; Paulo César Pinheiro; Sonia
Braunstein Faldini; Wagner José Saldanha. São Paulo: Makron, 1994. 1268p
FELTRE,
Ricardo. Fundamentos de Química: vol. único. 4ª.ed. São Paulo:
Moderna, 2005. 700 p.
<http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_inorganicas.pdf>
<http://www.joinville.udesc.br/portal/professores/frxavier/materiais/Fun__es_Inorg_nicas.pdf>
Referências - Imagens
Indicações Bibliográficas
Após cada postagem sempre deixaremos links e livros para
aqueles que desejam se aprofundar mais no assunto. Quem sabe não se tornam
grandes cientistas no futuro?!
Então, aqui segue nossa indicação:
<http://www.qieducacao.com/2011/05/nomenclatura-dos-acidos.html>








Parabéns, muito legal esse estudo dos oxiácidos
ResponderExcluirMuito obrigado, Valclayton! Continue lendo e aprendendo com nossos posts! :)
ResponderExcluir