Sejam muito bem vindos ao Breaking IFES.
Em virtude de avaliação pelo professor de Química, Breno Lima Rodriguez, essa fonte de estudos foi criada. Aqui publicaremos conteúdos sobre Química, os quais estaremos estudando posteriormente. Todo conteúdo aqui divulgado será avaliado pelo orientador. Mas não somente para ser avaliado, o site terá função de esclarecer dúvidas de demais alunos sobre conteúdos que estudaremos e publicaremos. Que o Breaking IFES seja muito útil e esclarecedor a todos. Bons estudos!
Hibridação
Existem 4 números quânticos definidos pelo cientista Schrödinger que têm como objetivo localizar um dado elétron na eletrosfera de um certo átomo. A cada número, possuímos uma localização mais específica e exata de onde se encontra o elétron, até chegarmos aos orbitais destes. Os números quânticos são explicados da seguinte maneira:
- Número quântico principal (n): indica a camada eletrônica de energia que o elétron se encontra. Vai de 1 a 7 (apesar de, teoricamente, poderem existir infinitas camadas eletrônicas). Podem ser representadas por letras maiúsculas que vão de K à Q.
- Número quântico secundário ou azimutal (l): indica o subnível de energia que o elétron ocupa dentro do nível da camada eletrônica. A soma do número quântico principal com o número quântico azimutal determina a energia intrínseca do elétron, isto é, a energia própria do elétron. Vai de 0 a 3 e pode ser representado pelas letras minúsculas s, p, d e f.
- Número quântico magnético (m): indica o estado de energia dentro do subnível, especificando mais ainda a quantidade de energia que o elétron apresenta. O número quântico magnético está diretamente ligado ao número quântico azimutal, mostrando o orbital no qual o último elétron da camada de valência se localiza. Cada subnível possui diferentes orbitais, cabendo ao número magnético definir em qual orbital esse elétron se localiza. Varia de –l até +l, sendo l a representação de número quântico azimutal.
- Número quântico de spin (s): Os elétrons não conseguem coexistir dentro de um mesmo orbital sem o spin, tendo em vista que a atração eletrostática destes os repeliria. A compensação dessa repulsão eletrostática (que de fato ocorre entre as duas partículas de mesma carga) se dá com a atração dos campos magnéticos gerados pelos elétrons ao girar em torno de seus próprios eixos. A isso se dá o nome de spin. A repulsão eletrostática então é compensada pela atração magnética dos spins, sendo o número quântico de spin o responsável por identificar a direção dessa rotação. É escrito apenas como +1/2 (que indica uma direção) ou -1/2 (que indica o lado oposto de +1/2). Vale lembrar que os spins dos elétrons devem ser opostos para coexistir num mesmo orbital, pois somente desse modo conseguem exercer a atração magnética um em relação ao outro e mantém-se na mesma área do orbital.
2. Da
ligação covalente
Dentro do tema ligações químicas tratamos das ligações covalentes, nas quais dois elementos compartilham pares de elétrons. A ligação pode ser caracterizada como simples, na qual apenas um par de elétrons é compartilhado; dupla, cujo compartilhamento é de dois pares de elétrons; tripla, na qual há o compartilhamento de três pares eletrônicos.
Com o objetivo de obter estabilidade, estágio de menor energia do átomo, os elétrons seguem a Regra do Octeto de Pauling1, imitando a distribuição dos gases nobres.
Ao observarmos os compostos formados por ligação covalente, notamos que existem exceções à Regra do Octeto, em que certos átomos se estabilizam com mais – ou menos – elétrons em sua camada de valência. Essas exceções que não seguem a Regra do Octeto proposta por Pauling são explicadas a partir de outra teoria também elaborada por Pauling, a Teoria da Hibridação.
1A Regra do Octeto se baseia na ideia de que em uma camada eletrônica, com exceção da camada K e da Q, a quantidade de elétrons necessária para fazer com que o átomo se estabilize é de 8 elétrons. Para que um átomo não tenha a necessidade de se ligar com outros átomos para atingir estabilidade, este precisa possuir 8 elétrons na camada de valência, assim como os gases nobres. Uma exceção de estabilidade observada é o Hélio que se encontra no menor estado de energia, ou seja, estável, com apenas dois elétrons na camada de valência.
3. Das
formas de ligação covalente
Já possuímos conteúdo suficiente para introduzir o conceito de interpenetração de orbitais, ou seja, a forma como os orbitais interagem na ligação covalente. Os tipos de ligação covalente se referem à forma como os orbitais atômicos de fato se ligam para a formação dos orbitais moleculares.
É necessário ressaltar, porém, que o âmbito ao qual estamos trabalhando é tridimensional, ou seja, possuímos três dimensões nas quais pode haver interpenetração de orbitais. Essas formas de interação de orbitais são divididas em duas:
Ligação Sigma (σ): ocorre a interpenetração dos orbitais no mesmo eixo, ou seja, frontalmente. Em todas as ligações covalentes (ligações simples, duplas ou triplas) serão encontradas ligações sigma. Como a interpenetração ocorre frontalmente entre os orbitais, podemos então definir quais os orbitais aptos a realizarem-na: pode ocorrer entre dois orbitais s, orbitais s e p e até mesmo entre dois orbitais p.
Ligação Pi (π): ocorre a criação de um plano através da interação entre orbitais p puros (sem que estejam envolvidos com o processo de hibridação) e paralelos entre si. Ocorre apenas entre dois orbitais p e serve, de modo geral, para aproximar os núcleos dos átomos que realizam a interpenetração de orbitais por meio da ligação sigma.
Abaixo uma imagem das ligações existentes na molécula C2H2 do ponto de vista dos orbitais, que ilustra de modo bem claro as interações dos orbitais.
Observe os orbitais p paralelos e a criação entre eles de um plano à parte da ligação, destinado à ligação Pi e a interação entre o átomo de Hidrogênio (H) frontalmente, ou seja, no mesmo eixo, caracterizando uma ligação Sigma.
Obs.: em ligações simples, ou seja, onde há apenas o compartilhamento de um par eletrônico, não possuímos ligações Pi, mas sim uma ligação Sigma. Em ligações duplas, ou seja, onde há dois pares de elétrons compartilhados, existe uma ligação Pi e uma ligação Sigma. Em ligações triplas, onde há três pares de elétrons compartilhados, existem duas ligações Pi e apenas uma ligação Sigma.
4. Dos
problemas com a Regra do Octeto
Nota-se que existem certos compostos que não deveriam existir, em razão de que para realizar uma ligação covalente, é necessário possuir elétrons desemparelhados na camada de valência, isto é, apenas 1 elétron ocupando o orbital, sendo o outro átomo ligante o responsável por compartilhar o outro elétron necessário para preencher o orbital totalmente. É possível concluir então, que os elétrons podem coexistir ao máximo em pares no mesmo orbital, sendo inconcebível a ideia de uma terceira partícula.
Além de não atenderem esta exigência para a ligação covalente, alguns compostos ainda não atendem a Regra do Octeto, necessária para haver a estabilidade das eletrosferas. Alguns átomos excedem a quantidade de ligações, aparecendo por vezes, com 10 ou até mesmo 12 elétrons na camada de valência.
Tomemos como exemplo então, o átomo de Berílio (Be), de número atômico 4 e com 4 elétrons na eletrosfera (estado fundamental). Realizando a distribuição do Berílio, temos:
Be – 1s² 2s²
Representação dos orbitais simplificados do Berílio na camada de valência, lembrando que as setas representam elétrons e a direção que estas apontam o sentido de seus spins:
Be – 2s2
Na camada de valência, possuímos o subnível s, que se encontra totalmente preenchido de elétrons, impossibilitando a existência de uma ligação química à primeira vista. Também encontramos o subnível p, que apesar de não estar sendo preenchido com elétrons, continua a existir como subcamada de energia.
Contudo, se o Berílio (Be) não possui átomos desemparelhados na camada de valência, como é possível a ligação química deste, e a existência do composto BeH2, por exemplo? Note que há a ligação de 1 átomo de Berílio (Be) com 2 de Hidrogênio (H), sendo necessário um par de elétrons desemparelhados para tal. Mas como seria essa ligação possível, se o átomo de Berílio não possui ao menos um elétron desemparelhado? Através de orbitais híbridos.
5. Da
Hibridação de orbitais atômicos
Hibridação, em Biologia, expressa a junção entre duas entidades gerando uma terceira com características medianas das duas primeiras. No estudo da Química, o princípio da hibridação com orbitais se mantem o mesmo, ou seja, dois orbitais atômicos unindo-se e provocando a criação de um terceiro, o qual possui características de seus precursores em mesma proporção.
Para que seja possível ligar um átomo que não possui elétrons desemparelhados, ou possui quantidade insuficiente destes para formar certos compostos, é necessário promover um dos elétrons emparelhados para um orbital de um subnível energético com energia superior; Tendo em vista que a discrepância de energia entre os subníveis é pequena, essa promoção se torna viável. Após ocorrer a ativação, isto é, a promoção citada que permite o desemparelhamento dos elétrons, ocorre de fato a hibridação, que é a junção dos orbitais envolvidos.
6. Dos
orbitais híbridos sp
Nesses orbitais há ocorrência da hibridação de um orbital s com um orbital p.
Retornando ao exemplo do composto BeH2, realizamos a demonstração do processo de Hibridação.
Be – 1s² 2s²
Última camada eletrônica do Berílio representada com os orbitais simplificados:
Be – 2s² 2p0
Para que haja ligação covalente como dito anteriormente, é necessário desemparelhar os elétrons do orbital s, promovendo um deles ao orbital p.
Be – 2s¹ 2p¹
Acima foi mostrado o processo de ativação, onde o elétron emparelhado é promovido a um subnível de energia ligeiramente superior.
A ligação química exige que a quantidade de energia dos elétrons seja exatamente a mesma, não permitindo nem mesmo a pequena diferença energética que existe entre os subníveis s e p. Ocorre então a fusão dos orbitais s e p, ou seja, a real hibridação:
Agora o Berílio (Be) é capaz de realizar duas ligações, possuindo dois elétrons desemparelhados.
O composto químico BeH2, através do processo híbrido, pode então, teoricamente, existir.
Tomemos agora o átomo Carbono (C), muito utilizado como exemplo em livros didáticos, pois realiza todas as formas de hibridação entre os orbitais s e p.
Buscando a demonstração de como o carbono realiza um tipo de hibridação, vamos usar de exemplo a molécula CO2.
O Carbono (C) realiza duas ligações duplas, uma com cada Oxigênio (O) ao seu redor. O processo de hibridação do Carbono é descrito abaixo e, logo após, algumas observações a serem consideradas.
Última camada eletrônica do Carbono em seu estado fundamental, representada em orbitais atômicos simplificados:
C – 2s22p2
Ocorre então, a ativação do átomo de Carbono (C):
Entretanto, na molécula de CO2, temos duas ligações duplas ocorrendo. Como visto anteriormente, ligações duplas se fazem com uma ligação do tipo Pi e outra ligação do tipo Sigma. Também vimos que ligações Pi não ocorrem em orbitais p híbridos, apenas em orbitais p puros. Então, durante o processo de ativação, o átomo separa dois orbitais p dotados de 1 elétron (cada qual desemparelhado), com o fim de realizar as ligações Pi necessárias.
Após a promoção de elétrons, ocorre de fato a hibridação dos orbitais do Carbono (C):
Dessa maneira, o Carbono (C) realiza duas ligações duplas com dois átomos de Oxigênio (O).
6.1
Da hibridação dos orbitais sp2
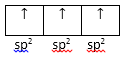
Ocorre a união de um orbital s com dois orbitais p. Segue a mesma lógica observada anteriormente no orbital híbrido sp. Exemplificaremos a seguir, tomando como primeiro exemplo a molécula de BH3.
A última camada do Boro (B) em estado fundamental representada por orbitais atômicos simplificados:
B – 2s22p1
Ocorre a ativação do elétron, na qual promovemos um elétron do subnível s para o subnível p:
B – 2s12p2
Há então a hibridação dos orbitais moleculares de energia semelhante:
Agora o Boro (B) possui a quantidade necessária de elétrons desemparelhados para realizar as três ligações simples, as quais todas são Sigmas. Dando-se ao final, a formação do composto de fórmula BH3.
Tomaremos novamente como exemplo mais uma forma de hibridação do átomo de Carbono (C) usando a molécula C2H4. Para a melhor visualização, usaremos também uma figura da estrutura da molécula, lembrando que duplas ligações são representadas por dois traços entre os átomos ligantes e ligações simples são representados apenas por um traço.
Para realizar a ligação dupla entre Carbono e Carbono da molécula acima, é necessária a reserva de 1 orbital p destinado à ligação Pi, presente entre os dois Carbonos. Realizaremos então o processo de hibridação passo a passo:
Camada de valência do Carbono (C) em estado fundamental representada com orbitais simplificados:
Reserva-se então 1 orbital p puro, que não realizará a hibridação e está destinado à ligação Pi entre os dois átomos de Carbono. Após isso, a hibridação:
Dessa forma, a molécula de C2H4 pode então, existir.
6.2
Da Hibridação dos orbitais sp3
Nessa hibridação há ocorrência da junção de um orbital s e três orbitais p. Levemos como exemplo a molécula CH4.
Para isso, ele promoverá um de seus elétrons do subnível s para o p, formando o orbital sp3e permanecendo com 4 elétrons desemparelhados no novo orbital. Após isso, precisamos encaixar cada um dos átomos hidrogênios nos orbitais do Carbono (C); totalizando as quatro ligações que este necessita.
Carbono no estado fundamental:
Carbono com a hibridação dos orbitais:
Após isso, cada Hidrogênio (H) preencherá um orbital do Carbono (C).
6.3
Da Hibridação dos orbitais sp3d
É ocorrente apenas em elementos encontrados no terceiro período da tabela periódica em diante, pois apenas estes possuem o subnível de energia d, mesmo que vazio. Quando há a junção de um orbital s com três orbitais p e um orbital d, gera-se um orbital sp3d. Tomemos como exemplo a molécula PCl5, onde o átomo estudado será o Fósforo (P).
Observe que, ao final da ligação, o Fósforo (P) estará estável com 10 elétrons na camada de valência, encaixando-se na Regra do Octeto Expandido2.
O processo de hibridação do Fósforo ocorre da seguinte forma:
Camada de valência do Fósforo (P):
P – 2s22p33d0
Ocorre a promoção do elétron do subnível s para o subnível d:
Com a promoção do elétron, acontece realmente a hibridação, em que todos os subníveis envolvidos são unidos, criando o subnível médio sp3d, onde possibilita que o Fósforo (P) realize 5 ligações ao invés das 3 que ele conseguiria no estado fundamental.
2Devido a impossibilidade de ajustar todos os elementos à Regra do Octeto, criou-se a Regra do Octeto Expandido, que aceita exceções de elementos que se estabilizam com mais de 8 elétrons em sua camada de valência.
6.4
Da Hibridação dos orbitais sp3d²
Acontece quando há a junção de um orbital s, três orbitais p e dois orbitais d. Daremos como exemplo a molécula de ácido sulfúrico, H2SO4, onde o Enxofre (S) será o átomo central3, o qual iremos estudar. Observaremos que o Enxofre será uma exceção à regra do octeto, se estabilizando com 12 elétrons na camada de valência e se encaixando também na Regra do Octeto Expandido.
Camada de valência do Enxofre (S) em estado fundamental representado com orbitais simples. Note que existe o subnível d, este apenas não está sendo usado.
Há a ativação do elétron do Enxofre (S), onde os elétrons emparelhados presentes nos subníveis s e p são promovidos ao subnível d.
Após a ativação, há então a Hibridação do átomo, criando os orbitais sp3d2. Gerando então seis possíveis ligações para o átomo de Enxofre (S) que, no estado fundamental (sem hibridação) era capaz apenas de duas ligações.
3 O átomo central é geralmente aquele que faz maior número de ligações dentro de uma molécula.
7. Da
Hibridação sem ativação
Certos átomos não têm condições de realizar a ativação em suas hibridações, pois eles possuem um ou dois orbitais p semipreenchidos, os que sobram cheios e não possuem o subnível d, impossibilitando a ativação dos elétrons, isto é, os subníveis apenas se unem e não há promoção eletrônica. Isso ocorre no átomo de Oxigênio (O) presente na molécula da água (H2O), por exemplo.
O Oxigênio possui 6 elétrons em sua valência, sendo representado dessa forma. (Representar a valência do Oxigênio)
O – 2s22p4
Na impossibilidade de realizar a ativação (o subnível p está cheio de elétrons desemparelhados e não existe subnível d, pois o oxigênio possui apenas duas camadas eletrônicas), os orbitais atômicos simplesmente se unem, formando o orbital híbrido sp3, onde não houve a ativação. (Mostrar o orbital híbrido sp3)
O motivo da existência da teoria da hibridação sem ativação se deve simplesmente ao fato de que, pelas explicações disponíveis, os cientistas não conseguiam caracterizar a geometria de certas moléculas. Retornando ao exemplo da água: a molécula, mesmo sem realizar a hibridação, pode existir, porém o ângulo da ligação entre as moléculas de Hidrogênio (H) e de Oxigênio (O) seria de 90°. Porém, o que se observa experimentalmente é a angulação de aproximadamente 104,5°! A única forma de explicar tal geometria é pela hibridação dos orbitais. Pela água não possuir orbitais p disponíveis para receber elétrons do subnível s, nem possuem o subnível d para receberem estes elétrons, ocorre então a hibridação sem ativação.
7. Das
Geometrias Moleculares
Tratando-se dos compostos moleculares, as ligações realizadas por eles acabam por determinar diferentes formas de organização dos núcleos dos átomos em volta da molécula formada. Essas formas de organização são denominadas geometria molecular.
A geometria dos compostos pode ser de dois tipos: Geometria dos Pares de Elétrons, que são considerados, em sua representação, os pares de elétrons não-ligantes, ou, a Geometria Molecular, que não considera os pares não ligantes. Apesar da diferença, precisaremos da Geometria dos Pares de Elétrons para determinar a Geometria Molecular, conforme será demonstrado posteriormente.
Após a ligação ser formada, os pares de elétrons dos átomos acabam se repelindo, e o átomo, consequentemente busca uma posição onde sofrerá a menor repulsão possível de todos os outros átomos da molécula. Os pares de elétrons não-ligantes também influenciam nessa repulsão, originando a geometria citada anteriormente (dos pares de elétrons), onde estes são representados para a formação da geometria do composto.
Lembre-se que o átomo existe em 3 dimensões, logo, quando os pares eletrônicos se repelem, estes buscam a maior distância possível, mas em um plano tridimensional. Você perceberá com as imagens, que quando eles se repelem geram um afastamento, formando ângulos entre os átomos. Cada geometria possui ângulos definidos.
As geometrias mais conhecidas e que serão citadas neste primeiro momento são mais simples. Já as geometrias mais complexas serão citadas posteriormente:
1- Linear
2- Angular
3- Trigonal Plana
4- Piramidal
5- Tetraédrica
Segue um quadro com as seguintes geometrias representadas:
Ao observar a fórmula de uma ligação covalente como é possível saber qual a sua geometria?
Primeiramente precisamos ter as valências dos elementos ligantes, ou seja, uma tabela em mãos ou dados de uma questão são essenciais. Posteriormente, deve-se representar a fórmula eletrônica do composto e contar quantos pares de elétrons existem ao redor do átomo central, levando em consideração os pares não ligantes.
Logo após isso, deve-se escolher a disposição geométrica que melhor distribui estes pares de elétrons com a maior distância possível, para que a força de repulsão seja mínima entre eles, ou seja, máxima distância. Devemos contar quantos desses pares existem ao redor do átomo central. Em geral, quando houver dois, três ou quatro pares (nuvens eletrônicas ligantes ou não-ligantes), as distribuições com maior afastamento possível serão respectivamente um segmento de reta, um triângulo equilátero ou um tetraedro.
Perceba que estão sendo considerados todos os pares de elétrons, ou seja, montamos a geometria dos pares. Após a formação dessa geometria, devem ser eliminados os pares não ligantes, pois apesar destes serem essenciais para a determinação da geometria molecular, eles não são representados nesta, pois estes já fizeram o papel de mostrar a geometria que determinam na molécula através da repulsão que geram. Portanto, eliminando-os, obtemos a Geometria Molecular.
Exemplos citados no quadro anterior a partir da geometria dos pares:
Na molécula angular do SO2, podemos observar que há uma ligação coordenada (dativa).
Mas agora que você já entende a hibridação, sabe que este tipo de ligação não ocorreria, uma vez que essa teoria se contradiz, pois segundo ela um dos átomos compartilha o par inteiro encaixando-o em um orbital vazio do átomo ao qual está se ligando, porém, na realidade há a distribuição de cada um dos elétrons em um orbital, o que faz com que a teoria da hibridação seja mais aceita atualmente. Logo, você interpretaria essa situação como uma hibridação do enxofre.
Um dos motivos da hibridação ser a teoria mais aceita atualmente para explicar certas ligações covalentes é que ela explica a geometria molecular de certos compostos acima, através das ligações que os átomos fazem.
Os pares eletrônicos que sobram do oxigênio fazem com que haja a repulsão dos pares eletrônicos dos hidrogênios, esses pares também se encaixam na geometria dos pares de elétrons, formando um tetraedro. Contudo, para serem representados os elétrons do subnível s neste tetraedro, hibridizamos o orbital s do oxigênio com o p, e, como não há para onde transferir elétrons, ocorre uma hibridação sem ativação, ou seja, os orbitais simplesmente se juntam.
A partir da montagem do tetraedro, com a exclusão dos pares de elétrons não-ligantes é formada a geometria molecular do composto, na qual este se torna angular, com um grau próximo da ligação tetraédrica normal (109º 28') tendo uma diferença ocasionada pelos pares de elétrons removidos, o que torna a água uma molécula angular, com um ângulo de 104º 5'.
REFERÊNCIAS:
PERUZZO, Francisco Miragaia. CANTO, Eduardo Leite do. Química na abordagem do cotidiano. Volume 1.
Professor consultado: Breno Lima Rodriguez.
RUSSEL, John B. Química
Geral, 2-ed, 2 vols.
Traduzido por: Márcia Guekezian; Maria
Cristina Ricci;
Maria Elizabeth Brotto; Maria Olívia A. Mengod; Paulo César Pinheiro; Sonia
Braunstein Faldini; Wagner José Saldanha. São Paulo: Makron, 1994. 1268p
MAHAN, Bruce M. & MYERS, Rollie J. Química, um curso
universitário, 4-ed. Traduzido por: Koiti Araki; Denise de Oliveira
Silva; Flávio Massao Matsumoto. São Paulo: Edgard Blücher, 1995. 582p.
<http://www.fcav.unesp.br/Home/departamentos/tecnologia/LUCIANAMARIASARAN/teoria-da-ligacao-de-valencia-e-orbitais-hibridos.pdf>
Indicações Bibliográficas
Após cada postagem sempre deixaremos links e livros para
aqueles que desejam se aprofundar mais no assunto. Quem sabe não se tornam
grandes cientistas no futuro?!
Então, aqui seguem nossas indicações:
Geometria molecular
<http://www.todamateria.com.br/geometria-molecular/>
<http://zeus.qui.ufmg.br/~qgeral/downloads/aulas/aula%2016%20-%20geometria%20molecular.pdf>
<http://zeus.qui.ufmg.br/~qgeral/downloads/aulas/aula%2014%20-%20polaridade%20e%20eletronegatividade.pdf>

.jpg)



































0 comentários
Postar um comentário